O ácido tartárico, C4H6O6 (conservante), usado em…
(USJT-SP) O ácido tartárico, C4H6O6 (conservante), usado em alguns refrigerantes, pode ser obtido a partir da uva durante o processo de fabricação do vinho. Se a concentração em quantidade de matéria de ácido tartárico num refrigerante é 0,175 mol/L, qual é a massa de ácido utilizada na fabricação de 100.000 L desse refrigerante?
a) 17.500 g
b) 116,6 kg
c) 0,857 t
d) 1,75 kg
e) 2,62 t
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
A concentração em quantidade de matéria, ou concentração em mol/L, é calculada dividindo-se a quantidade em mols (n) do soluto pelo volume da solução em litros (V). Assim, temos:
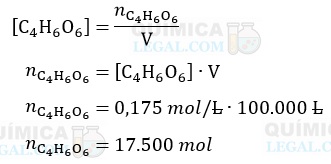
A massa de uma substância pode ser calculada multiplicando-se a quantidade de matéria por sua massa molar, onde a última é obtida consultando-se a tabela periódica. Logo:
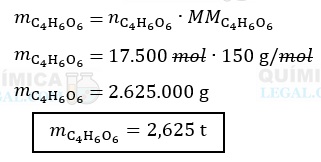
Lembre-se de que: 1 t = 1.000 kg = 1.000.000 g.
Portanto, a massa de ácido tartárico empregada na fabricação de 100.000 L do refrigerante, é igual a 2,625 toneladas.
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS sobre SOLUÇÕES.
Veja também: FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da USJT?



