O azoteto de sódio, NaN3, quando inflamado…
(UFPE) O azoteto de sódio, NaN3, quando inflamado sofre decomposição rápida fornecendo nitrogênio gasoso que é utilizado para inflar os sacos de ar (airbags) de automóveis, de acordo com a reação:
2 NaN3(s) → 2 Na (s) + 3 N2(g)
Quantos mols de azoteto de sódio são necessários para gerar nitrogênio suficiente para encher um saco de plástico de 44,8 L a 0 °C e à pressão atmosférica?
Dados:
- R = 0,082 atm ∙ L/mol ∙ K;
- massa atômica (g/mol): N = 14; Na = 23.
Considere que o nitrogênio gasoso tem comportamento ideal nas condições acima.
a) 1/3
b) 2
c) 3
d) 2/3
e) 4/3
Resolução
Primeiramente, temos que encontrar a quantidade de matéria do gás N2 necessária para encher o saco (cujo volume é igual 44,8 L). Para isso, utilizaremos a equação dos gases ideais:

Segundo a equação química balanceada, apresentada no enunciado, 3 mols de N2 são produzidas a partir da decomposição de 2 mols de NaN3. Sendo assim, a quantidade de NaN3 necessária para produzir 2 mols de nitrogênio é dado por:
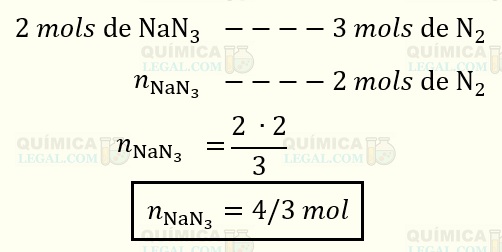
Obs: pressão atmosférica = 1 atm
Portanto, 4/3 mol (ou 1,33 mol) de NaN3 é suficiente para encher o airbag.
Gabarito: LETRA E
Confira mais EXERCÍCIOS RESOLVIDOS sobre ESTEQUIOMETRIA.
Veja também: EXERCÍCIOS DE QUÍMICA GERAL E INORGÂNICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da UFPE?


