O calor de combustão do acetileno com oxigênio do ar…
(Unip-SP) O calor de combustão do acetileno com oxigênio do ar é 310 kcal/mol. A vaporização da água líquida consome aproximadamente 10 kcal/mol. Quantos mols de acetileno, C2H2(g), devem ser queima dos para produzir calor suficiente para evaporar 360 g de água líquida?
a) 0,500
b) 0,645
c) 1,30
d) 2,50
e) 2,84
Resolução
Segundo o enunciado, são necessários 10 kcal de energia na forma de calor para vaporizar 1 mol de água. Assim, o calor necessário para vaporizar 360 g de H2O é dado por:

Ainda de acordo com o enunciado, a combustão de 1 mol de acetileno libera 310 kcal de energia na forma de calor. Assim, a quantidade de acetileno necessária para liberar 200 kcal de energia é dada por:
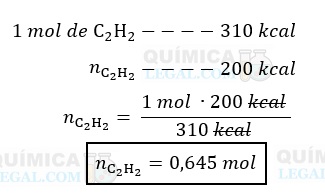
Gabarito: LETRA B
Confira mais EXERCÍCIOS RESOLVIDOS sobre TERMOQUÍMICA.
Veja também: FÍSICO-QUÍMICA
Gostaria de ver mais RESOLUÇÕES COMENTADAS da Unip?


