O carbonato de cálcio, principal constituinte do calcário, é um sal…
(Unesp 2003) O carbonato de cálcio (CaCO3), principal constituinte do calcário, é um sal usado na agricultura para corrigir a acidez do solo. Esse sal, ao ser aquecido vigorosamente, sofre decomposição térmica, produzindo óxido de cálcio (CaO) e gás carbônico (CO2). Considerando a massa molar do CaCO3 = 100 g/mol, do CaO = 56 g/mol e do CO2 = 44 g/mol, e que 10 kg de carbonato de cálcio puro sofreram decomposição térmica, a quantidade de óxido de cálcio produzido será de:
a) 2.200 g.
b) 2.800 g.
c) 4.400 g.
d) 5.600 g.
e) 11.200 g.
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
A decomposição térmica do carbonato de cálcio (CaCO3), que resulta na formação de óxido de cálcio (CaO) e dióxido de carbono (CO2), pode ser representada pela equação química balanceada:
CaCO3(s) → CaO(s) + CO2(g)
É importante ressaltar que a equação já está balanceada, garantindo que a quantidade de átomos de cada elemento químico seja a mesma em ambos os lados da reação, tanto nos reagentes quanto nos produtos.
De acordo com essa equação, a decomposição de 1 mol de carbonato de cálcio produz 1 mol de óxido de cálcio e 1 mol de dióxido de carbono. Dessa forma, podemos aplicar uma regra de três simples para calcular a massa de óxido de cálcio produzida quando 10 kg de CaCO3 sofrem decomposição térmica, como demonstrado a seguir:
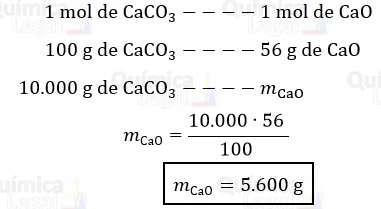
Para converter a massa de CaCO3 de quilograma (kg) para grama (g), foi utilizada a relação conhecida em que 1 kg é igual a 1.000 g.
Portanto, a decomposição térmica de 10 kg de carbonato de cálcio produz 5.600 g, ou 5,6 kg, de óxido de cálcio. Logo, a alternativa correta é a letra D.
Gabarito: LETRA D
Confira Também
- Exercícios Resolvidos sobre Estequiometria
- Exercícios de Química Geral e Inorgânica Resolvidos
- Resoluções Comentadas da Unesp-SP
- Livros de Química Resolvidos


