Reação de um metal alcalino com água
(ITA) Suponha que um pesquisador tenha descoberto um novo elemento químico, M, de número atômico 119, estável, a partir da sua separação de um sal de carbonato. Após diversos experimentos foi observado que o elemento químico M apresentava um comportamento químico semelhante aos elementos que constituem a sua família (grupo).
a) Escreva a equação balanceada da reação entre o elemento M em estado sólido com a água (se ocorrer).
b) O carbonato do elemento M seria solúvel em água? Justifique a sua resposta.
Resolução
a) Supondo que o elemento M, de número atômico 119, existisse, ele estaria posicionado logo abaixo do Fr (frâncio). Logo, pertenceria ao grupo 1 da tabela periódica, ou família dos metais alcalinos. E o seu comportamento químico, de acordo com o enunciado, seria semelhante aos dos outros metais alcalinos. Dessa forma, quando fosse combinado com água formaria um óxido e gás hidrogênio, como mostrado na equação química a seguir:
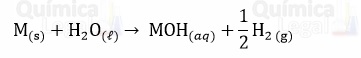
b) Já é bastante conhecido que os carbonatos dos metais alcalinos são solúveis em água, portanto, caso o elemento existisse também formaria carbonato solúvel em água.
Confira mais EXERCÍCIOS RESOLVIDOS sobre LIGAÇÕES QUÍMICAS.
Tá afim de ver mais RESOLUÇÕES COMENTADAS do ITA?



