Um gás foi colocado em um aquecedor e ganhou 5500 kJ…
(Princípios de Química, Atkins) Um gás foi colocado em um aquecedor e ganhou 5500 kJ de energia na forma de calor. Se o volume do cilindro aumentou de 345 mL para 1846 mL contra uma pressão atmosférica de 750 Torr durante o processo, qual é a variação de energia interna do gás no cilindro?
Resolução
O calor é definido como a transferência de energia que ocorre devido a uma diferença de temperatura entre corpos, fluindo do corpo com temperatura mais alta para o corpo com temperatura mais baixa. Por convenção, o calor (q) é positivo quando o sistema absorve calor e negativo quando libera calor.
O trabalho, em termodinâmica, é calculado pelo produto entre a pressão (P) e a variação do volume (ΔV). Por convenção, o trabalho é positivo quando realizado contra o sistema (como na compressão de um gás) e negativo quando realizado pelo sistema (como na expansão de um gás).
De acordo com a 1ª Lei da Termodinâmica, a variação da energia interna (ΔU) de um sistema fechado é igual à soma do calor (q) e do trabalho (W), conforme a fórmula:

No sistema descrito, o gás absorve calor do meio externo e se expande, então a fórmula pode ser reescrita como:
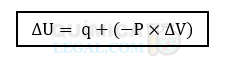
Para calcular ΔV, subtraímos o volume inicial do volume final:

Antes de substituir os valores na equação, é necessário converter a pressão de torricelli (Torr) para pascal (Pa) e o volume de mililitro (mL) para metro cúbico (m3). Isso porque o produto Pa⋅m3 é igual a joules (J), a unidade de energia no Sistema Internacional de Unidades (SI).
Sabemos, pela tabela de conversão, que:
- 1 Torr = 133.323 Pa
- 1 mL = 1×10−6 m3
Convertendo a pressão:

Convertendo a variação do volume:

Agora, substituímos esses valores na equação da 1ª Lei da Termodinâmica:

A variação da energia interna do gás durante o processo é +5.499,85 kJ. Isso significa que a energia interna do gás aumentou em 5.499,85 kJ, resultado do calor adicionado e do trabalho realizado pelo gás durante a expansão. Note que a energia perdida devido à expansão do gás é significativamente menor em comparação com a energia recebida na forma de calor.


