Uma solução aquosa de sulfato de alumínio foi…
(Química 2, Martha Reis) Uma solução aquosa de sulfato de alumínio foi preparada de modo que cada 100 mL de solução tivesse 68,4 g do sal dissolvido a 20 °C. Nessa temperatura o grau de dissociação α% do Aℓ2(SO4)3(aq) é igual a 60%. Calcule:
a) a concentração em quantidade de matéria do sal na solução;
b) a concentração em quantidade de matéria dos íons Aℓ3+(aq) e SO42–(aq).
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
a) Primeiramente temos que converter a massa do sulfato de alumínio (Aℓ2(SO4)3) em quantidade de matéria:
n = m / MM
n = 68,4 g / 342 g/mol
n = 0,2 mol
Para calcular a concentração do sal na solução, em mol/L, basta dividir a quantidade de matéria pelo volume da solução em litros, 0,1 L, logo:
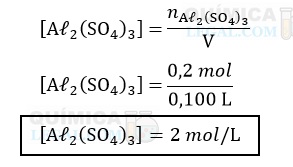
b) Equação balanceada da dissociação do sulfato de alumínio:
Aℓ2(SO4)3(aq) → 2 Aℓ3+(aq) + 3 SO42–(aq)
A proporção estequiométrica nos diz que a dissociação de 1 mol de Aℓ2(SO4)3 produz 2 mols de Al3+ e 3 mols de SO42−. Assim, para a dissociação de 0,2 mol de Aℓ2(SO4)3 (68,4 g) temos:

Essas seriam as quantidades de matéria dos íons caso a dissociação apresentasse um grau de dissociação igual a 100%. Mas, segundo o enunciado o grau de dissociação é igual a 60%. Logo:

Por fim, basta dividir as quantidades em mols pelo volume da solução em litros, 0,10 L:

Confira mais EXERCÍCIOS RESOLVIDOS sobre SOLUÇÕES.
Gostaria de ver mais LIVROS RESOLVIDOS DE QUÍMICA?



