O CO2 produzido pela decomposição térmica de…
(Cesgranrio-RJ) O CO2 produzido pela decomposição térmica de 320 g de carbonato de cálcio teve seu volume medido a 27 °C e 0,8 atm. (Dados: Ca = 40; C = 12; O = 16; R = 0,082 atm.L/mol.K). O valor, em litros, encontrado foi:
a) 22,4.
b) 44,8.
c) 67,2.
d) 71,6.
e) 98,4.
Resolução
Equação balanceada da decomposição do CaCO3:
CaCO3(s) → CaO(s) + CO2(g)
Então, para cada mol de CaCO3 que sofre decomposição é gerado 1 mol de CO2.
Sabemos ainda que 1 mol de qualquer gás na CNTP (1 atm e 0 ºC) ocupa 22,4 L, logo:

Agora para encontrar o volume de CO2 a 27 °C e 0,8 atm, basta utilizarmos a equação geral dos gases:

Lembre-se de que: TK = TºC + 273
Gabarito: LETRA D
Resolvendo pela Equação de Clapeyron
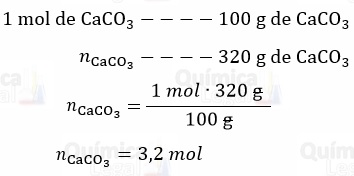
De acordo com a equação química balanceada, a relação estequiométrica é de 1:1, logo:
nCaCO3 = nCO2 = 3,2 mol
Então, substituindo os valores na equação de Clapeyron temos:

Lembre-se de que: TK = TºC + 273
Gabarito: LETRA D
Confira mais EXERCÍCIOS RESOLVIDOS de ESTEQUIOMETRIA.
Gostaria de ver mais RESOLUÇÕES COMENTADAS do Cesgranrio?


