Para sua completa neutralização, uma amostra de…
Para sua completa neutralização, uma amostra de vinagre de 5,0 mL consumiu 25 mL de uma solução que contém 0,20 mol/L de hidróxido de sódio. Supondo que o único componente ácido do vinagre seja o ácido acético (CH3COOH), calcule a massa, em gramas, do ácido contida em 1 L de vinagre.
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
Primeiramente devemos calcular a quantidade em mols de NaOH adicionada na titulação:
[NaOH] = nNaOH / V
nNaOH = [NaOH] ∙ V
nNaOH = 0,2 mol/L ∙ 0,025 L
nNaOH = 0,005 mol
A reação de neutralização do ácido acético pode ser representanda pela equação química a seguir:
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(ℓ)
Conforme a equação acima, a neutralização de 1 mol de ácido acético consome 1 mol de NaOH. Assim, temos:
nNaOH = nCH3COOH = 0,005 mol
Então, se em 5 mL de vinagre há 0,005 mol de ácido acético, para 1 L (1.000 mL) temos:
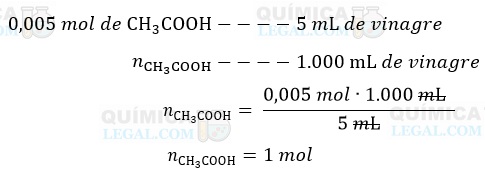
A massa molar do ácido acético é igual a 60 g/mol (calculada a partir da tabela periódica). Portanto, em um litro do vinagre analisado, há 60 gramas (1 mol) de ácido acético.
Confira mais EXERCÍCIOS RESOLVIDOS sobre VOLUMETRIA DE NEUTRALIZAÇÃO.



