A concentração molar de uma solução aquosa…
A concentração molar de uma solução aquosa de cloreto de lantânio (LaCℓ3) pode ser determinada por volumetria de precipitação usando-se uma solução padrão de oxalato de sódio (Na2C2O4), precipitando-se o oxalato de lantânio por meio da reação equacionada na forma iônica
2 La3+(aq) + 3 C2O42-(aq) → La2(C2O4)3(s)
Qual é a molaridade de uma solução de LaCℓ3, se são necessários 20,0 mL para reagir com 14,1 mL de Na2C2O4 0,0226 mol/L? Quantos gramas do precipitado oxalato de lantânio (MM = 542 g/mol) se formam nesta titulação?
Resolução
Cálculo da quantidade de matéria de Na2C2O4 em 14,1 mL (0,0141 L) de solução:
[Na2C2O4] = n(Na2C2O4) / V
n(Na2C2O4) = [Na2C2O4] ∙ V
n(Na2C2O4) = 0,0226 mol/L ∙ 0,0141 L
n(Na2C2O4) = 3,19 × 10-4 mol
De acordo com a equação química apresentada, já balanceada, são necessários 3 mols de Na2C2O4 para precipitar 2 mols de La3+. Assim, temos:
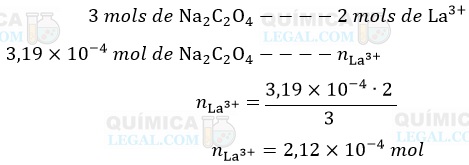
Se em 20 mL de solução há 2,12 × 10-4 mol de LaCℓ3, em 1.000 mL (1 L) de solução temos:
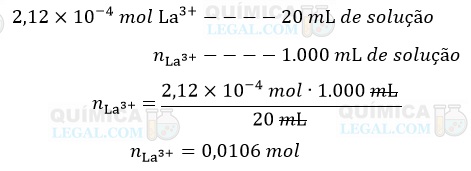
Portanto, a molaridade da solução de LaCℓ3 é igual a 0,0106 mol/L.
Agora, temos que calcular a massa do precipitado. Segundo a equação apresentada no enunciado, a precipitação de 2 mols de La3+ produz 1 mol de La2(C2O4)3. Assim, temos:
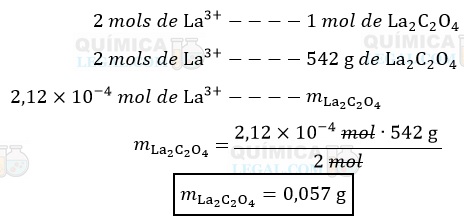
Portanto, a titulação de 20 mL da solução de cloreto de lantânio produz 0,057 g de oxalato de lantânio.
Confira mais EXERCÍCIOS RESOLVIDOS sobre VOLUMETRIA DE PRECIPITAÇÃO.

