Uma amostra de salmoura foi analisada por…
Uma amostra de salmoura (NaCℓ em solução aquosa) foi analisada por titulação argentimétrica (método de Mohr) por um analista que transferiu 10,00 mL da amostra para um erlenmeyer e titulou com 32,75 mL de uma solução de nitrato de prata (AgNO3) 0,100 mol/L (fator de correção= 0,9950). Calcular as concentrações de NaCℓ ( MM= 58,5 g/mol) na salmoura em g/L e mol/L.
Resolução
Reação de precipitação do cloreto:
NaCℓ(aq) + AgNO3(aq) → AgCℓ(s) + NaNO3(aq)
Para corrigir a concentração da solução padrão de AgNO3, basta multiplica-la pelo fator de correção:
[AgNO3] = 0,1 mol/L ∙ 0,9950
[AgNO3] = 0,0995 mol/L
Cálculo da quantidade de matéria de AgNO3:
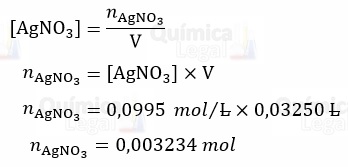
De acordo com a equação da reação de precipitação, a a relação estequiométrica é de 1:1, logo:
nAgNO3 = nAgCℓ = 0,003234 mol
Dessa forma, a concentração, em mol/L, da alíquota de 10 mL (0,01 L) é dada por:
[NaCℓ] = nAgCℓ / V
[NaCℓ] = 0,003234 mol / 0,01 L
[NaCℓ] = 0,3234 mol/L
Para converter a concentração de mol/L para g/L, basta multiplicarmos pela massa molar do NaCℓ:
CAgCℓ = [NaCℓ] ∙ MMAgCℓ
CAgCℓ = 0,3234 mol/L ∙ 58,5 g/mol
CAgCℓ = 18,9 mol/L
Confira mais EXERCÍCIOS RESOLVIDOS sobre VOLUMETRIA DE PRECIPITAÇÃO.



