Para realizar a titulação de 20 mL de hidróxido de sódio…
Para realizar a titulação de 20 mL de hidróxido de sódio (NaOH) de molaridade desconhecida, foram utilizados 50 mL de ácido sulfúrico (H2SO4) 0,2 molar. Qual a molaridade do hidróxido de sódio?
Utilize a tabela periódica para calcular as massas molares quando necessário.
Resolução
Cálculo da quantidade de matéria do ácido sulfúrico em 50 mL (0,05 L):
[H2SO4] = n(H2SO4) / V
n(H2SO4) = [H2SO4] ∙ V
n(H2SO4) = 0,2 mol/L ∙ 0,05 L
n(H2SO4) = 0,01 mol
Reação de neutralização entre o ácido sulfúrico e o hidróxido de sódio:
H2SO4(aq) +2 NaOH(aq) → Na2SO4(aq) + 2 H2O(ℓ)
De acordo com a equação química balanceada, a neutralização de 1 mol de ácido sulfúrico consome 2 mols de hidróxido de sódio, logo:
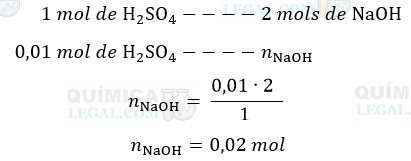
Se em 20 mL da solução há 0,02 mols de NaOH, em 1.000 mL (1 L) temos:
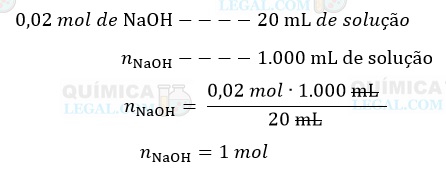
Portanto, a molaridade da solução de NaOH titulada é igual a 1 mol/L.
Confira mais EXERCÍCIOS RESOLVIDOS sobre VOLUMETRIA DE NEUTRALIZAÇÃO.


